El átomo de Rutherford
Era casi tan increíble como si disparásemos un proyectil de 38 centímetros contra una hoja de papel de seda, y del choque se volviera contra nosotros y nos hiriera.
Rutherford, Teoría de la estructura atómica
 Ernest Rutherford (1871-1937)
Ernest Rutherford (1871-1937)
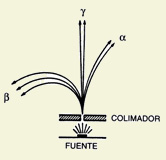 Emisión de partículas radioactivas
Emisión de partículas radioactivas
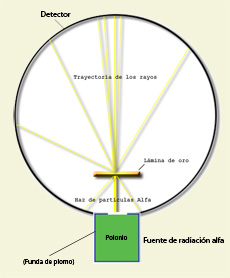 Experimento de Rutherford
Experimento de Rutherford
 Modelo de un átomo complejo
Modelo de un átomo complejo
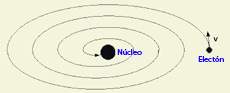 Catástrofe ultravioleta
Catástrofe ultravioleta
Al mismo tiempo que se diseñaban modelos para los átomos con estructura, numerosos hechos nuevos daban testimonio de esa complejidad interior que ya sugerían tanto los espectros discretos y singulares de la luz emitida por los diferentes elementos químicos como las regularidades periódicas que manifestaban esos elementos clasificados por familias en la Tabla de Mendeleyev. Súbitamente, a finales del siglo XIX y comienzos del XX, radiaciones de todo tipo eran detectadas en los laboratorios más importantes; radiaciones que intrigaban a los investigadores y atraían el interés del gran público por sus extrañas propiedades. Los rayos X, los rayos α,β y γ , etc., además de constituir el núcleo de muchos de los artículos que se publicaban en las más relevantes revistas científicas pasaron a ocupar, también, amplio espacio en los periódicos de la época.
El interior del átomo se convirtió en territorio a explorar y pasó a convertirse en lo que los científicos denominan una “caja negra” – un recinto que no podemos explorar directamente y cuyo contenido hay que inferir analizando los estímulos a los que se la somete y la respuesta que nos suministra.
Será el neozelandés E. O. Rutherford quien aplicará este modelo de investigación al átomo y a este fin bombardeará una fina lámina de oro con partículas α –el estímulo– para, posteriormente, someter a análisis la deflexión que experimentan estas partículas tras interaccionar con los átomos –la respuesta–. De este análisis concluiría que un átomo con la estructura propuesta por Thomson era incapaz de explicar los resultados obtenidos; se vio obligado, pues, a construir un nuevo modelo en el que aparecía por primera vez la imagen de un núcleo con carga positiva y una corteza en la que, para conseguir, al menos en primera instancia, cierta estabilidad orbitaban los electrones: el modelo atómico planetario adquirió, así, su primera configuración. La naturaleza parecía adoptar soluciones similares tanto en el macrocosmos como en el microcosmos: sistemas planetarios en escalas sucesivas.
La historia, como de todos es conocido, no tendría aquí su final porque este átomo, construido de acuerdo con las leyes de la física clásica albergaba en sí mismo las causas de su destrucción: estaba inexorablemente condenado al colapso. En efecto, las cargas eléctricas que Rutherford había puesto en movimiento alrededor del núcleo no son tan indiferentes a su movimiento como lo son los planetas alrededor del Sol y los cambios que experimenta su dirección de movimiento las convierten en partículas aceleradas que radian, de acuerdo con las leyes de Maxwell, energía. Esta radiación hace que su velocidad vaya disminuyendo y con ello la amplitud de su movimiento rotatorio hasta que, finalmente, acabarían precipitándose sobre el núcleo: la materia no sería estable y los objetos no mantendrían su forma y textura. En cierta forma este resultado era una nueva manifestación de otro problema, surgido en la interpretación clásica de la radiación del llamado cuerpo negro, al que los científicos habían etiquetado con el nombre de catástrofe ultravioleta.
La resolución del enigma que esta catástrofe ocultaba corresponde ya a una nueva etapa de la ciencia física que recorrerá todo el siglo XX. Se inicia con la hipótesis cuántica de Plank, prosigue con la explicación corpuscular del efecto fotoeléctrico por Einstein y tiene en el átomo cuántico de Bohr la expresión seminal en lo que concierne al problema que nos ocupa: la construcción de un modelo satisfactorio para los átomos con estructura. Sobre las intuiciones del científico danés se irá articulando un nuevo y extraño modo de mirar el mundo en el que la mayor parte de los presupuestos que sustentaban la visión clásica –de los que ya hicimos recuento al iniciar esta serie de artículos– terminarán siendo abandonados. Un mundo que hará exclamar a un famoso científico, J. B. S. Haldane:
El universo no sólo es más extraño que como lo imaginamos, es incluso más extraño que lo que podemos imaginar.
Relatar este fascinante viaje queda para otro momento y para otros cronistas. Nuestra tarea, ofrecer una panorámica rápida sobre parte de la ciencia de finales del siglo XIX y comienzos del XX, concluye aquí.
Actividades
- Estudia con más detalle el fenómeno de la radioactividad.
- Explica el experimento de Rutherford.
- Infórmate sobre el contenido de lo que se conoce como "catástrofe ultravioleta".